pH (meet)principe - hoe werkt een pH meting - de theorie
Het begrip pH staat voor de zuur(te)graad van waterige vloeistoffen.
Waar hebben we het dan over: de pH komt overeen met de activiteit van de hydronium ionen in oplossing, waarbij de activiteit vergelijkbaar is met concentratie. Eigenlijk is het dus zo dat de pH een maat is voor de H3O+ concentratie.
Wanneer de H3O+ concentratie hoger wordt, wordt de pH waarde juist lager: hoe lager de pH hoe zuurder de oplossing is. Een hoge pH waarde geeft aan dat de vloeistof basisch is.
Een pH schaal loopt normaliter van 0-14pH (er zijn weliswaar omstandigheden waarbij de pH hoger of lager kan zijn, dit laten we hier verder buiten beschouwing).
Een pH meting bestaat in principe uit de volgende onderdelen:
Een pH elektrode: geeft een spanning af die afhankelijk is van de pH waarde van de vloeistof
Een referentie elektrode: geeft een stabiele (referentie) spanning af
Een temperatuurvoeler: meet de temperatuur van de vloeistof
Elektronica: zet het gemeten signaal om naar een pH waarde volgens de volgende formule:
Emeting = E0 + C log a(H+). Volgens de definitie van pH is pH = -log a(H+). Dit geeft als resultaat: pH = (E meting - E0)/59,16 (@ 25°C)
Hoe ziet een pH meting er in realiteit (meestal) uit:
Een combi elektrode (bestaat uit pH elektrode + referentie elektrode + (evt.) temperatuurelektrode)
(Evt.) een losse temperatuurelektrode
Een aanwijzer, pH meter en/of transmitter
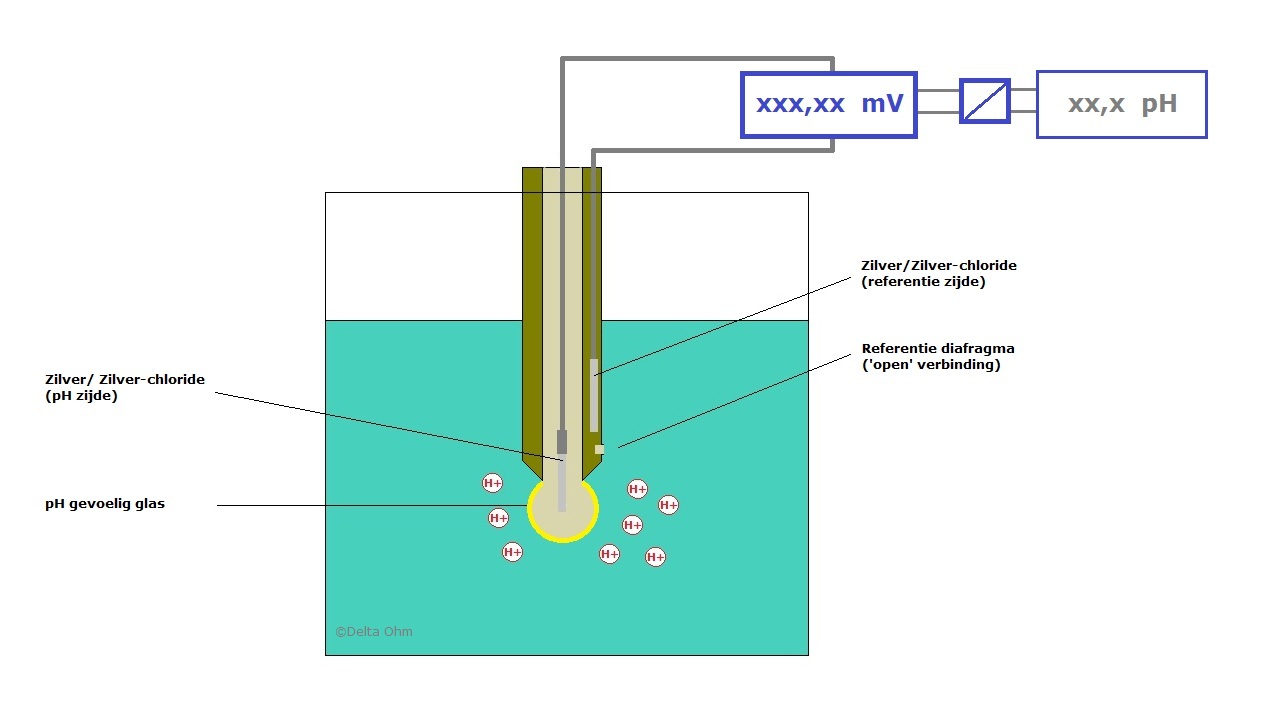
Het meetgedeelte van de pH elektrode bestaat uit pH gevoelig glas. Op dit pH gevoelige glas ontstaat onder invloed van vocht een 'H+ gevoelige' laag. Hierdoor wordt een spanning opgewekt.
Deze spanning heeft een referentiepunt nodig (de + en de 0 van de meting). Dit referentiepunt is spanning die door de referentie elektrode wordt opgewekt.
Tussen deze elektrodes zorgt de vloeistof er voor dat de 'stroomkring' wordt gesloten. Dit geeft meteen aan waarom de vloeistof elektrisch geleidend moet zijn voor een pH meting. Zie de volgende tekening:
Tussen het glas en de referentieopening wordt de stroomkring gesloten. De referentieopening is een open verbinding tussen het inwendige van de referentie elektrode en de vloeistof. De stroomkring kan worden verbroken doordat deze opening verstopt raakt = vervuiling.
Ook wanneer het glas zwaar vervuilt zou zijn (er vormt zich een laagje om het pH glas heen) zal de pH meting niet meer werken. Het mag duidelijk zijn dat het meten in vervuilende vloeistoffen niet eenvoudig is en dat hiervoor speciale maatregelen moeten worden getroffen.
De spanning die wordt opgewekt door de pH meting wordt gemeten door een mV meter die het signaal, gecompenseerd voor temperatuurinvloed, omzet naar een pH uitlezing.
Bij een meting van 0 mV zal de pH meter een waarde van (ongeveer) pH 7 laten zien. Even als verduidelijking: er wordt dus ook pH 7 aangegeven wanneer je de pH elektrode kapot zou slaan. Dit is iets om goed in gedachten te houden, want het geeft een goed handvat bij het zoeken en verhelpen bij storingen of defecten.
Het 'zien' van een pH 7 aanwijzing geeft als eerste gedachte: de meter doet het, want er wordt iets gemeten. Het tegendeel is waar: er wordt 0 (= niets) gemeten.
pH meters, pH testers - waarom een pH meter en geen pH tester?
Kortgezegd: serieus meten kan niet met een pH tester. Bent u hobbyist en wilt u, puur uit interesse zonder dat daar gevolgen aan kleven, een idee hebben van de pH in uw aquarium? Pak een strookje pH gevoelig papier en meet daar mee. Een pH tester (u kent ze vast wel: mooi LCD display met 2 cijfers achter de komma...) geeft een illusie van nauwkeurigheid. U kunt er echter weinig mee. Ons advies: doe het goed of doe het niet. De opmerking, mijn pH waarde is niet zo belangrijk dus ik meet wel met een simpele meter of tester, geeft al aan dat u net zo goed niet kunt meten.
Meten is weten....?
Dit gaat bij pH niet altijd op. Hier kun 'iets' meten en 'niets' weten. Het vervelende is n.l. dat een pH meetsysteem altijd wel iets zal aangeven. Zoals gezegd, een kapotte elektrode geeft 0mV is pH7. Of, als de pH elektrode al wat slechter was, een waarde van ca. pH6,5 tot pH7,5. U kunt op basis van deze aanwijzing conclusies gaan trekken die dus volkomen misplaatst zijn! Aangezien de meters en elektrodes van Delta Ohm van een zeer hoge kwaliteit zijn en bovendien ingebouwde controles hebben, is de kans op fouten hiermee bijzonder klein.
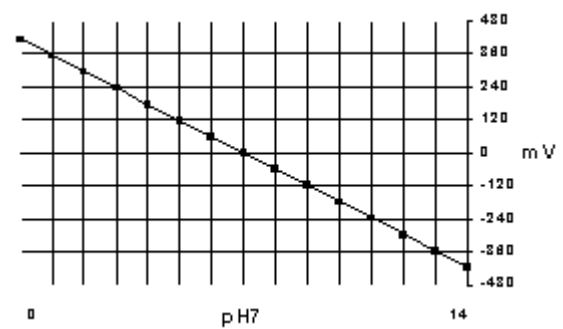
pH signaal t.o.v. spanning in milli Volts
In dit grafiekje is duidelijk te zien hoe het spanningsverloop is van een pH elektrode. Bij pH7 is de spanning 0. Afhankelijk van de temperatuur zal de spanning per pH deel toe- of afnemen. Deze af- of toename is ook waar voor gecompenseerd wordt door de temperatuurvoeler in de meetkring. De temperatuurcompensatie wordt dus gebruikt voor het compenseren van het gedrag van de elektrode bij verschillende temperaturen.
Een glaselektrode heeft bij 25°C in ideale omstandigheden een slope ('hellingshoek') van 59,16mV per pH. Afhankelijk van de temperatuur wordt deze slope anders. Bij b.v. 50°C is dat 64,12mV per pH.
Een bekend verschijnsel (waar we vaak vragen over krijgen) is: in het proces is mijn pH 10,3. Ik neem een monster en neem dat mee naar het laboratorium en meet dan 9,2 pH. Conclusie: één van beide meters is onnauwkeurig...
Antwoord: het kan natuurlijk altijd dat één van beide meters de afwijking veroorzaakt. Maar: in veel gevallen is dit een gevolg van iets anders, n.l. van het feit dat de pH van de vloeistof echt verandert bij verschillende temperaturen. Dat is niet bij iedere vloeistof het geval, maar het kan voorkomen.
Wanneer in het laboratorium zou worden gemeten bij b.v. 21°C en in het proces is gemeten bij 75°C, dan is de kans groot dat dit een gevolg is van een echte pH wijziging in de vloeistof. Voor dit soort veranderingen is wel te compenseren, maar dan moet de pH variatie van de vloeistof van te voren bekend zijn. In dat geval kun je evt. een compensatiewaarde in de transmitter ingeven. Let op: de standaard temperatuurcompensatie van een pH meter compenseert niet voor een temperatuursafhankelijke verandering van de pH van de vloeistof, maar alleen voor het veranderende gedrag van de elektrode bij verschillende temperaturen.
Gebruik van een pH meting
Hoe gebruik je een pH meter? Met enige voorzichtigheid, dat in ieder geval. Zoals uitgelegd is de elektrode van glas. Dat betekent dat stoten, laten vallen etc. niet bepaald een goede garantie is voor een lange levensduur.
Daarnaast: wees bedacht op het feit dat 0mV een waarde van ongeveer pH 7 geeft. Een sterk vervuilde of kapotte elektrode kan dus een meetwaarde geven die 'neutraal ' lijkt, maar dat hoeft niet waar te zijn. het is gemakkelijk te controleren of de pH elektrode nog goed is. Check in pH4 buffer of hierbij een goede aanwijzing plaatsvindt. (zie verder kalibratie).
Kalibratie van een pH meter, ISO regelgeving kalibratie pH
Hoe kalibreer je een pH meter of pH meting?
Hoe vaak moet mijn pH meter gekalibreerd worden?
Binnen ISO moeten alle meetinstrumenten bij ons bedrijf jaarlijks worden gekalibreerd, hoe zit dat met een pH meter?
Zomaar een paar vragen die ons regelmatig worden gesteld. In het volgende stuk wordt e.e.a. behandeld.
Hoe kalibreer je een pH meter of pH meting?
Nodig: 5 bekerglazen, buffers pH6,86 en pH4,01, spoelwater.
Zorg er voor dat de elektrode schoon is. Reinig deze eventueel met reinigingsvloeistof.
- spoel de sensor voor in pH 6,86
- plaats de elektrode in pH 6,86 en kalibreer deze met behulp van de kalibratieroutine van het instrument
- spoel de elektrode af met water
- spoel de elektrode voor in pH 4,01
- plaats de elektrode in pH 4,01 en kalibreer deze met behulp van de kalibratieroutine van het instrument
Het instrument is nu op 2 punten gekalibreerd. Wanneer de verwachten meetwaarde onder de pH 7 ligt is dit de goede routine; ligt de te verwachten meetwaarde boven pH 7 dan kalibreert men bij voorkeur op pH 7 en pH 9.
Eventueel kan, voor een nauwkeurige meting over het gehele bereik bij de meeste meetinstrumenten op meerdere punten worden gekalibreerd. Zo heeft u de meest juiste instelling voor het gehele bereik van 0-14pH.
Hoe vaak moet mijn pH meter gekalibreerd worden?
Dit is voornamelijk afhankelijk van de nauwkeurigheid die u wenst te bereiken. In de meeste gevallen is een simpele controle de beste oplossing. Zet de elektrode in pH6,86 en kijk of dit overeenkomt met de aanwijzing, spoel de elektrode etc. (zie de procedure) en zet de elektrode in pH4 (pH9). Wijst de meter op beide waardes goed aan dan is kalibratie onnodig. Afhankelijk van de gewenste nauwkeurigheid en de mate van gebruik zou u kunnen beginnen met een wekelijkse controle van de waarden. Geen afwijking? Dan kunt u deze periode verlengen. U vindt zo de meest optimale kalibratie interval vanzelf.
Binnen ISO moeten alle meetinstrumenten bij ons bedrijf jaarlijks worden gekalibreerd, hoe zit dat met een pH meter?
Zoals al aangegeven is het regelmatig kalibreren van een pH meter en elektrode iets wat door de gebruiker moet worden gedaan. Het is niet zo dat een jaarlijkse kalibratie volgens ISO dit kan opvangen.
De jaarlijkse ISO kalibratie is er op gericht om de nauwkeurigheid van de elektronica van de meter te beoordelen. Niet om de ´dagelijkse´ meetnauwkeurigheid te garanderen.
Wat moet je zeker niet doen met een pH meter en elektrode?
- NIET met de pH sensor ergens tegen aanstoten of deze laten vallen (let op: de sensor is van glas)
- NIET de sensor mechanisch te zwaar belasten (bij montage 'wringen')
- NIET de sensor droog wegleggen (zet deze in bewaarvloeisof)
- NIET de sensor wegzetten in demi-water (dit is funest voor de elektrode!)
- NIET een elektrode te lang (meer dan 30 minuten) in de schoonmaakvloeistof wegzetten
- NIET een bestaande pH kabel verlengen of inkorten (de afscherming om de kabel is zeer complex)
- NIET een pH elektrode in de directe nabijheid van een 'stoorbron' (bv een frequentieregelaar of motor) toepassen
- NIET een pH kabel (mV signalen) in dezelfde kabelgoot plaatsen als sterkstroomkabels
Wat kan er fout gaan
Een heleboel! Een pH meting is op zich niet moeilijk, maar we hebben daarnaast ook te maken met chemie en elektronica, dat maakt het complex.
Wanneer u de meter niet kunt kalibreren, of wanneer de meting erg traag of instabiel is, kan dit verschillende oorzaken hebben. Hieronder treft u een aantal mogelijke oorzaken en oplossingen aan.
Bijvoorbeeld: de meting is instabiel, de pH blijft heen en weer gaan.
Mogelijke oorzaken:
- het glas van de pH elektrode kan beschadigd zijn door ruw gebruik: vervangen van elektrode is de oplossing
- de elektrode is vervuild en heeft hierdoor geen open referentie verbinding met het medium: reinig de elektrode
- het glas van de elektrode is vervuild: reinig de elektrode
- de kabel van de elektrode (of connector) is beschadigd en maakt slecht elektrisch contact: repareer/vervangen
- storende invloeden van elektrische signalen (van bv een pomp) waardoor het mV signaal van de elektrode wordt verstoord
- kalibratie vloeistof is vervuild of verouderd: neem altijd schone en dus 'verse' vloeistof voor een kalibratie
- elektrode kan vervuild zijn (aanslag op glas of referentie): zet de elektrode een half uur in reinigingsvloeistof
- uitlezing is niet stabiel: elektrode te droog, laat deze een aantal uren staan in bewaarvloeistof.
Kan een pH meter wel worden gekalibreerd op pH6,86 (pH7) en niet op pH4?
Denk er aan dat de pH6,86 (pH7) overeenkomt met ca. 0mV. Een kapotte elektrode zal dus nog steeds een 'goede' waarde aangeven in pH6,86.
Controleer eerst in de meetstand wat de aanwijzing is bij pH4. Is deze b.v. pH6? Dan is de slope van de elektrode (door wat voor reden dan ook) vrijwel 0 geworden. Mogelijke oorzaken zijn: zware vervuiling, verstope diafragma, kapotte elektrode etc.